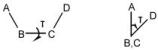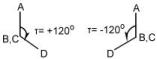BIOΦΥΣΙΚΗ
ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ
ΧΡΗΣΗ ΜΟΡΙΑΚΩΝ ΜΟΝΤΕΛΩΝ ΣΤΕΡΕΟΔΙΑΤΑΞΙΚΗ ΑΝΑΛΥΣΗ ΧΡΗΣΙΜΟΠΟΙΩΝΤΑΣ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ ΠΟΛΥΠΕΠΤΙΔΙΚΕΣ ΑΛΥΣΙΔΕΣ

Βασιλική Α. Οικονομίδου & Σταύρος Ι. Χαμόδρακας
Τομέας Βιολογίας Κυττάρου και Βιοφυσικής
Τμήμα Βιολογίας
Παν/μιο Αθηνών
Φεβρουάριος 2002
I. ΧΡΗΣΗ ΜΟΡΙΑΚΩΝ ΜΟΝΤΕΛΩΝ
Η γνώση της τρισδιάστατης δομής των βιολογικών μακρομορίων είναι απαραίτητη για την κατανόηση των χημικών, φυσικοχημικών και βιολογικών τους ιδιοτήτων.
Π.χ., σ΄ ένα ένζυμο θέλουμε να ξέρουμε τον τρόπο με τον οποίο ορισμένα αμινοξικά κατάλοιπα πλησιάζουν με το 'δίπλωμα' του μορίου, για να σχηματίσουν εκείνη την ακριβή διευθέτηση, γνωστή σαν ενεργό κέντρο, που επιτρέπει στο ένζυμο να έχει την ειδική δράση του.
Όσο μεγελώνει η πολυπλοκότητα του μορίου που μελετάμε, τόσο περισσότερο αυξάνει η δυσκολία να αντιληφθούμε την τρισδιάστατη διευθέτηση των ατόμων που το αποτελούν και γι΄αυτό το λόγο αναγκαζόμαστε να χρησιμοποιούμε μοντέλα.
Τα μοντέλα αυτά όχι μόνο αυξάνουν την κατανόηση του τρόπου δράσης των μορίων όταν έχει καθοριστεί η δομή τους, αλλά παίζουν επίσης σπουδαίο ρόλο στον καθορισμό της ίδιας της δομής.
Στη μεθοδολογία της κρυσταλλογραφίας ακτίνων-Χ, που κατ΄αρχήν επιτρέπει να καθοριστεί η δομή ενός μορίου από τη γνώση των περιθλασιγραμμάτων του, στην πράξη βρίσκουμε ότι προκύπτουν συνήθως πολλά προβλήματα, που σπάνια επιτρέπουν να πάρουμε μια και μοναδική λύση στο πρόβλημά μας.
Για να παρακάμψουμε τα εμπόδια αυτά πρέπει συνήθως να χρησιμοποιήσουμε τις προηγούμενες γνώσεις μας και όσον αφορά τη μοριακή και ατομική δομή. Τέτοιες γνώσεις περικλείονται στα μοριακά μοντέλα.
Έτσι αντιμετωπίζουμε συνδυασμένα το πρόβλημα του καθορισμού της δομής: Χρησιμοποιούμε τα δεδομένα που παίρνουμε από τα περιθλασιγράμματα ακτίνων-Χ και προσπαθούμε να φτιάξουμε μια λογική δομή με τα μοντέλα μας συμπληρώνοντας τα κενά εφόσον το επιτρέπουν τα μοντέλα.
Κατόπιν, υπολογίζουμε το διάγραμμα περίθλασης που περιμένουμε από το μοντέλο και το συγκρίνουμε με αυτό που παρατηρήθηκε πραγματικά. Αν υπάρχουν διαφορές τροποποιούμε το μοντέλο μας και επαναλαμβάνουμε τους υπολογισμούς μέχρις ότου οι διαφορές είναι αρκετά μικρές ώστε να γίνουν επιτρεπτές.
Περιγραφές μοντέλων :
Δύο διαφορετικά είδη μοντέλων χρησιμοποιούμε συνήθως :
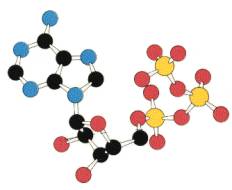
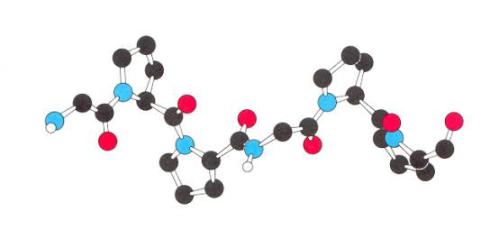
I. Χωροπληρωτικά μοντέλα (space-filling models) του τύπου Courtauld.
Tα άτομα παριστάνονται σε σχήμα και μέγεθος με στερεές χρωματιστές πλαστικές μονάδες που μπορούν να συνδεθούν μεταξύ τους με ειδικές συνδέσεις, συνήθως μεταλλικές. Δίνουν την καλύτερη οπτική εντύπωση του σχήματος του μορίου και επιτρέπουν άμεσο έλεγχο των επιφανειών επαφής διαφορετικών τμημάτων του.
Τα μειονεκτήματα που παρουσιάζουν είναι η δύσκολη στήριξή τους και το γεγονός ότι περιοχές στο εσωτερικό μεγαλομορίων δεν μπορούν να μελετηθούν.
Χωροπληρωτικό μοντέλο ATP
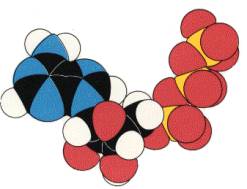
II. 'Σκελετικά' μοντέλα (Skeletal models)
Σ' αυτά, οι δεσμοί μεταξύ ατόμων παριστάνονται σε μήκος και διεύθυνση με μεταλλικές ράβδους, γύρω από τις οποίες (εφ' όσον πρόκειται για απλούς δεσμούς) υπάρχει η δυνατότητα περιστροφής. Οι πυρήνες των ατόμων θεωρούνται στα σημεία επαφής των μεταλλικών ραβδών. Τέτοια μοντέλα δείχνουν την βασική γεωμετρία των μορίων και επιτετρέπουν άμεση μελέτη των δυνατών στεροεδιατάξεων.
Οι αποστάσεις και οι γωνίες που χρησιμοποιούνται σε όλα τα είδη μοριακών μοντέλων βρέθηκαν παίρνοντας τις μέσες τιμές από τις καλύτερες πειραματικά γνωστές τιμές δεσμών και γωνιών που πάρθηκαν από τη μελέτη πολλών μικρομορίων.
Για διάφορους λόγους, πολλές φορές παρατηρούναι σημαντικές αποκλίσεις απ΄αυτές τις μέσες τιμές και αυτό πρέπει να λαμβάνεται σοβαρά υπ΄ όψη πριν παρθούν τελικά συμπεράσματα από την κατασκευή των μοντέλων.
Σκελετικά μοντέλα ATP
Κώδικας χρωμάτων που χρησιμοποιούνται συνήθως στα μοντέλα:
Άνθρακας: Μαύρο
Οξυγόνο: Κόκκινο
Άζωτο: Γαλάζιο
Υδρογόνο: Λευκό
Θείο: Κίτρινο
Φώσφορος: Πορφυρό
II. ΣΤΕΡΕΟΔΙΑΤΑΞΙΚΗ ΑΝΑΛΥΣΗ ΧΡΗΣΙΜΟΠΟΙΩΝΤΑΣ ΜΟΡΙΑΚΑ ΜΟΝΤΕΛΑ – ΠΟΛΥΠΕΠΤΙΔΙΚΕΣ ΑΛΥΣΙΔΕΣ
Από πολλές απόψεις είναι σημαντικό να ξέρουμε την τρισδιάστατη δομή μιας πρωτεΐνης. Ο καθορισμός της όμως είναι μια δύσκολη και κουραστική δουλειά και παίρνει πολύ χρόνο και πειραματικά μέσα. Υπάρχει μια σχολή σκέψης που πιστεύει ότι μπορούμε να προβλέψουμε με θεωρητικούς υπολογισμούς τη δομή μιας πρωτεΐνης και η εργαστηριακή αυτή άσκηση έχει σχεδιαστεί έτσι ώστε να δείχνει τα πρώτα βήματα που έγιναν προς αυτή την κατεύθυνση.
Μια πρωτεΐνη είναι ένα πολύπλοκο συγκρότημα αμινοξικών καταλοίπων. Παρ' όλ' αυτά, μπορούμε να απλοποιήσουμε το πρόβλημα αρχίζοντας με την υπόθεση ότι έχουμε ένα πολυ-αμινοξύ π.χ. πολυαλανίνη
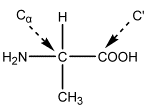 |
Αλανίνη |
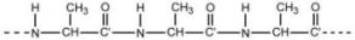 |
Πολυαλανίνη |
H πεπτιδική ομάδα είναι ένα σταθερό συγκρότημα ατόμων, περίπου επίπεδη (και συνήθως trans), αφού ο χαρακτήρας μερικού διπλού δεσμού του N = C' δεσμού εμποδίζει περιστροφή γύρω απ' αυτόν.
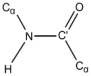
Έτσι, οι μοναδικοί βαθμοί ελευθερίας είναι οι περιστροφές γύρω από τους απλούς δεσμούς Ν -- Cα και Cα -- C΄. Οι γωνίες στροφής γύρω από αυτούς τους δεσμούς ονομάζονται φ και ψ αντίστοιχα.
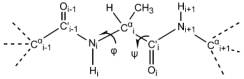
Στην πολυαλανίνη (σύμφωνα με την αρχή της στερεοδιαταξικής ισοδυναμίας) δεν υπάρχει λόγος ένα κατάλοιπο να είναι διαφορετικό από ένα άλλο, δηλαδή όλα τα κατάλοιπα πρέπει να έχουν τις ίδιες τιμές γωνιών φ και ψ. Θα μπορούσαμε επομένως να καθορίσουμε τη δομή της πολυαλανίνης αναφέροντας απλώς ένα ζευγάρι γωνιών φ και ψ.
Μια ερώτηση που θα μπορούσε να τεθεί σ' αυτό το σημείο είναι:
Eίναι όλες οι δυνατές τιμές των φ και ψ επιτρεπτές;
Θα πρέπει να περιμένουμε ότι ορισμένα ζευγάρια τιμών φ, ψ δεν είναι επιτρεπτά αφού φέρουν άτομα σε μικρές αποστάσεις μεταξύ τους, ώστε να δημιουργείται στερεοχημική παρεμπόδιση.
Η ερώτηση που θα απαντήσουμε στο πρακτικό μέρος της άσκησης είναι:
Ποιές είναι οι επιτρεπτές και ποιές οι μη επιτρεπτές τιμές των φ και ψ;
III. ΠΡΑΚΤΙΚΟ ΜΕΡΟΣ
1. Στην άσκηση δίνονται (σκελετικά) μοντέλα υπό μεγάλη κλίμακα (4 cm --> 1 A). Αναγνωρίστε τα άτομα από τον κώδικα των χρωμάτων.
2. Δίνεται επίσης μηχανισμός που επιτρέπει τη μέτρηση των γωνιών φ και ψ. (Η συνθήκη για τον καθορισμό των φ και ψ περιγράφεται στο παράρτημα Ι).
3. Αρχικά το μοντέλο τοποθετείται στη στερεοδιάταξη 00, 00 και εξετάζεται αν υπάρχουν στερεοχημικές παρεμποδίσεις μεταξύ ατόμων. Οι ελάχιστες κανονικά επιτρεπτές αποστάσεις μεταξύ δύο 'αδέσμευτων' ατόμων (ατόμων που δεν είναι συνδεδεμένα με δεσμούς δηλαδή ατόμων που απέχουν τουλάχιστον 3 δεσμούς) δείχνονται στον πίνακα του παραρτήματος ΙΙ κατά προσέγγιση.
> Κατασκευάστε πίνακα με τρεις στήλες. Στις δύο τοποθετούνται τα ζευγάρια τιμών φ, ψ και στην τρίτη δείχνεται αν η στερεοδιάταξη είναι ή όχι επιτρεπτή.
> Αυξάνεται τη γωνία ψ διαδοχικά κατά 450 μέχρι να επανέλθετε στην αρχική στερεοδιάταξη, εξετάζοντας κάθε φορά αν η στερεοδιάταξη είναι ή όχι επιτρεπτή (και κρατώντας την φ=00).
> Αυξάνεται τη φ κατά 450 και επαναλαμβάνετε την ίδια διαδικασία όπως προηγουμένως για την ψ, εξετάζοντας πάλι ποιές είναι οι επιτρεπτές ή όχι στερεοδιατάξεις.
> Η διαδικασία επαναλαμβάνεται μέχρι να εξαντληθούν όλα τα δυνατά ζευγάρια φ, ψ. Τα αποτελέσματα μπορούν να αποδοθούν κατασκευάζοντας το λεγόμενο Ramachandran plot (Aναφ. 1).
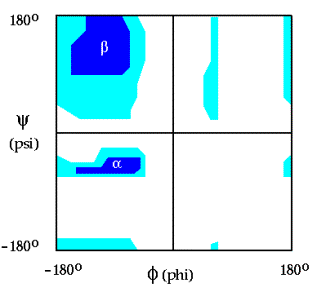
4. Κατασκευάστε το Ramachandran plot στο χαρτί σχεδίασης που σας δίνεται.
5. Όταν συμπληρώσετε την κατασκευή θα ξέρετε ποιές δομές είναι επιτρεπτές αλλά δεν θα ξέρετε ποιές είναι πιό σταθερές (από ενεργειακή άποψη). Μια από τις πιο ισχυρές δυνάμεις σταθεροποίησης στις πρωτεΐνες είναι η δημιουργία υδρογονικών δεσμών (του τύπου C=O...H-N).
Xρησιμοποιώντας τα μοντέλα δημιουργείστε πολυπεπτιδικές αλυσίδες (το πολύ 7 αμινοξικών καταλοίπων) σ΄ επιτρεπτές στερεοδιατάξεις και εξετάστε πολλές από αυτές, για να δείτε ποιές επιτρέπουν σ΄ όλες τις Ν-Η και C=O ομάδες να σχηματίζουν υδρογονικούς δεσμούς (είτε στην ίδια αλυσίδα ή σε διαφορετικές αλυσίδες). Μπορείτε να υποθέσετε ότι τα άτομα C=O...H-N είναι περίπου στην ίδια ευθεία και ότι η απόσταση Ο-Ν είναι περίπου 3 A. Θυμηθήτε ότι κάθε κατάλοιπο θα πρέπει να έχει τις ίδιες γωνίες φ και ψ.
ΠΑΡΑΡΤΗΜΑ Ι
Συνθήκη καθορισμού γωνιών στροφής :
Η πιο πρόσφατη συνθήκη για τον καθορισμό των γωνιών στροφής φ και ψ περιγράφεται αναλυτικά στην αναφ. 2. Συνοπτικά μπορεί να περιγραφεί ως εξής:
Γωνία στροφής (torsion angle) τ (A-B-C-D) τεσσάρων ατόμων (όπως στο σχήμα) Α, Β, C, D ορίζεται η γωνία που σχηματίζεται μεταξύ των προβολών των δεσμών ΑΒ και CD σ΄ένα επίπεδο κάθετο στο δεσμό Β-C (κοιτώντας κατά μήκος του Β-C από το Β προς το C). Mπορεί να οριστεί επίσης σαν η δίεδρη γωνία μεταξύ των επιπέδων ΑΒC και BCD.
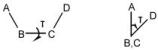
Η γωνία τ παίρνεται 00 όταν η προβολή του CD δεσμού επικαλύπτεται από την προβολή του ΑΒ (eclipsed conformation) και 1800 όταν βρίσκεται στην προέκτασή του (staggered conformation).
Mια γωνία τ έχει πεδίο ορισμού από -1800 < τ < +1800. Το πρόσημο της γωνίας καθορίζεται σε σχέση με την περιστροφή που απαιτείται ώστε η προβολή του ΑΒ δεσμού να επικαλύψει την προβολή του CD δεσμού.
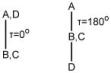
Παίρνεται + (00 --- +1800) αν η περιστροφή είναι σύμφωνα με τη φορά των δεικτών του ρολογιού και – (00 -- -1800) αν είναι αντίθετα.
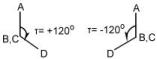
Στην περίπτωση μιας πολυπεπτιδικής αλυσίδας παίρνεται φ=ψ=1800 όταν η αλυσίδα είναι τελείως εκτεταμένη. Οι γωνίες φ και ψ του καταλοίπου i είναι οι γωνίες στροφής C'i-1-Ni-Ci-C'i και Ni-Ci-C'i-Ni+1 αντίστοιχα.
ΠΑΡΑΡΤΗΜΑ ΙI
Ελάχιστες κανονικά επιτρεπτές αποστάσεις μεταξύ 'αδέσμευτων' ατόμων:
C-->C = 3.0 A
H-->H = 2.0 A
C-->H = 2.4 A
N-->H = 2.4 A
O-->H = 2.4 A
C-->O = 2.9 A
N-->O = 2.8 A
C-->N = 2.9 A
ANAΦΟΡΕΣ
1. The structure and action of proteins, R.E. Dickerson and I. Geis (1969), Harper and Row (pub.), London.
2. IUPAC-IUB. Commission on Biochemical Nomenclature (1969) in Biochemistry, (1970), Vol. 9, No18, 3471-3478.
3. Edsall, J.T., Flory, P.J., Kendrew, J.C., Liquori, A.M., Nemethy, G., Ramachandran, G.N. and Scheraga, H.A. (1966), Biopolymers, 4, 130.