ΒΙΟΦΥΣΙΚΗ
ΕΡΓΑΣΤΗΡΙΑΚΗ ΑΣΚΗΣΗ
ΣΤΕΡΕΟΔΙΑΤΑΞΙΚΗ ΑΝΑΛΥΣΗ ΜΙΚΡΟΜΟΡΙΩΝ ΜΕ ΤΗ ΧΡΗΣΗ ΚΛΑΣΣΙΚΩΝ ΗΜΙΕΜΠΕΙΡΙΚΩΝ ΕΝΕΡΓΕΙΑΚΩΝ ΥΠΟΛΟΓΙΣΜΩΝ
Εφαρμογή στην εύρεση των στερεοδιατάξεων ελάχιστης ενέργειας ενός διπεπτιδίου
Κυριακή Σ. Παύλου & Σταύρος Ι. Χαμόδρακας
Τομέας Βιολογίας Κυττάρου & Βιοφυσικής
Τμήμα Βιολογίας
Πανεπιστήμιο Αθηνών
Φεβρουάριος 2002
Ι. ΣΤΕΡΕΟΔΙΑΤΑΞΙΚΗ ΕΝΕΡΓΕΙΑ-ΕΝΕΡΓΕΙΑΚΟΙ ΠΑΡΑΓΟΝΤΕΣ
Η στερεοδιάταξη ενός συγκεκριμένου μορίου μπορεί να περιγραφεί εύκολα ορίζοντας τις γωνίες στροφής του ( βλ. Άσκηση 1).
Στη μεθοδολογία της στερεοδιαταξικής ανάλυσης, για να μελετήσουμε τις σταθερές στερεοδιατάξεις ενός μορίου, πρέπει να βρούμε τις στερεοδιατάξεις ελάχιστης ενέργειας σαν συνάρτηση των γωνιών στροφής του μορίου (έχοντας εκφράσει την ενέργεια σαν αναλυτική συνάρτηση των ατομικών θέσεων, των χημικών δεσμών και των ενδοατομικών δυνάμεων).
Η ολική ενέργεια μιας στερεοδιάταξης μπορεί να εκφραστεί, με καλή προσέγγιση, σαν το άθροισμα επί μέρους παραγόντων που προέρχονται από διάφορους τύπους αλληλεπιδράσεων μεταξύ "αδέσμευτων" ατόμων (ατόμων που δεν συνδέονται με ομοιοπολικούς δεσμούς), και από επιπλέον όρους που εκφράζουν την ενέργεια που προκύπτει από παραμόρφωση δεσμών και γωνιών.
Η σχέση που εκφράζει την ολική ενέργεια μιας στερεοδιάταξης με καλή προσέγγιση (Αν.1) είναι:
V=Va+Vr+Ves+Vhb+Vl+VT+VΦ+VS (1)
όπου:
Va = Ενέργεια ελκτικών δυνάμεων Van der Waals
Vr = Ενέργεια απωστικών δυνάμεων
Ves = Ενέργεια ηλεκτροστατικών αλληλεπιδράσεων
Vhb = Ενέργεια σχηματισμού υδρογονικών δεσμών
Vl = Ενέργεια λόγω παραμόρφωσης μήκους δεσμού
VT = Ενέργεια λόγω παραμόρφωσης γωνίας δεσμού
VΦ = Ενέργεια σαν συνέπεια της περιστροφής γύρω από δεσμούς
VS = Ενέργεια που περιγράφει την επίδραση του διαλύτη που περιβάλλει το μόριο
Μια σύντομη ανάλυση των όρων που συνεισφέρουν στην ολική ενέργεια είναι η εξής:
1. Ενέργεια ελκτικών δυνάμεων Van der Waals
Οι δυνάμεις αυτές ονομάζονται και London dispersion forces. Κλασσικά, σ΄ ένα άτομο, λόγω της κίνησης των ηλεκτρονίων του, είναι δυνατό το κέντρο βάρους του θετικού φορτίου να μη συμπίπτει στιγμιαία μ΄ εκείνα του αρνητικού. Δημιουργείται έτσι ένα πρόσκαιρο δίπολο που επιδρά σ΄ ένα γειτονικό άτομο και προκαλεί πόλωση από επαγωγή. Τα δημιουργούμενα στιγμιαία δίπολα αλληλεπιδρούν και η ενέργεια αλληλεπίδρασης δίνεται από την σχέση
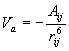 |
(2) |
όπου Αij μια σταθερά που έχει σχέση με τις ιδιότητες (συγκεκριμένα το πολώσιμο) των ατόμων που αλληλεπιδρούν και rij η απόσταση των ατομικών κέντρων i, j.
2. Ενέργεια απωστικών δυνάμεων
Η εμφάνιση απωστικών δυνάμεων είναι αποτέλεσμα της αλληλοεισδοχής των ηλεκτρονικών νεφών δύο ατόμων, όταν αυτά πλησιάσουν αρκετά. Ο υπολογισμός της ενέργειας τέτοιων αλληλεπιδράσεων γίνεται συνήθως χρησιμοποιώντας το γενικό τύπο :
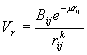 |
(3) |
Όπου Βij, μ και Κ σταθερές και rij η απόσταση ατόμων i, j.
Παρουσιάζεται όμως το πρόβλημα ποιές τιμές θα δοθούν στα Βij, μ, και Κ. Στην βιβλιογραφία έχουν χρησιμοποιηθεί διαφορετικές εκφράσεις όπως ο τύπος
Buckingham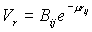 και ο τύπος Lennard-Jones
και ο τύπος Lennard-Jones 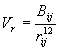 (4)
(4)
Η σταθερά Bij στην περίπτωση που χρησιμοποιείται η σχέση Lennard-Jones μπορεί να υπολογιστεί, θεωρώντας ότι η ελάχιστη τιμή ενέργειας πετυχαίνεται σε μια ατομική απόσταση Rij, όπου Rij είναι το άθροισμα Van der Waals των ακτίνων των αλληλεπιδρώντων ατόμων.
Ο υπολογισμός δίνει: 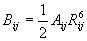
Ο όρος αυτός συνδυαζόμενος με την ενέργεια των ελκτικών δυνάμεων δίνει για την ενέργεια ελκτικών και απωστικών δυνάμεων την έκφραση:
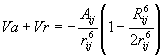 |
(5) |
Ο πίνακας Ι δίνει ένα σύνολο τιμών των σταθερών Αij, Rij, Bij (Scot and Scheraga, 1966, αναφ. 2) για διάφορα είδη αλληλεπιδράσεων.
(Το πρόβλημα της εκλογής των σταθερών και πληρέστερη ανάλυση των όρων που συνεισφέρουν στην ολική ενέργεια θα βρει ο αναγνώστης στις αναφορές 1, 3, 4).
ΠΙΝΑΚΑΣ Ι
Τυπικές σταθερές Αij και Βij στο δυναμικό Lennard-Jones 6-12
| Αλληλεπίδραση |
Rij (A) |
Aij |
Bij x 10-4 |
C…C |
3.40 |
370 |
28.6 |
C…N |
3.25 |
366 |
21.6 |
C…O |
3.22 |
367 |
20.5 |
C…H |
2.90 |
128 |
3.8 |
N…N |
3.10 |
363 |
16.1 |
N…O |
3.07 |
365 |
15.3 |
N…H |
2.75 |
125 |
2.7 |
O…O |
3.04 |
367 |
14.5 |
O…H |
2.72 |
124 |
2.5 |
H…H |
2.40 |
46.7 |
0.45 |
Η χρήση των σταθερών αυτών δίνει την ενέργεια σε 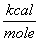 αν το r τεθεί σε A.
αν το r τεθεί σε A.
3. Ενέργεια ηλεκτροστατικών αλληλεπιδράσεων
Για τον υπολογισμό της ενέργειας ηλεκτροστατικών αλληλεπιδράσεων μπορούμε να θεωρήσουμε κάθε άτομο φορτισμένο, ακόμη και αν συμμετέχει στον σχηματισμό ομοιοπολικού δεσμού (εκλέγοντας τα φορτία έτσι ώστε ν΄ αναπαριστάνουν τη συνεχή κατανομή φορτίου του μορίου).
Σ΄ αυτήν την περίπτωση, η ενέργεια για μια αλληλεπίδραση ατόμων i, j υπολογίζεται από την σχέση:
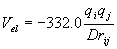 |
(6) |
όπου qi, qj τα φορτία των ατόμων i, j σε μονάδες ηλεκτρονικού φορτίου (σαν κλάσματα του φορτίου του ηλεκτρονίου), rij η απόσταση των ατόμων i, j σε A και D η διηλεκτρική σταθερά του μέσου. Η σταθερά 332.0 έχει εκλεγεί έτσι ώστε η ενέργεια να υπολογίζεται σε
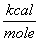 .
.
Η χρήση της σχέσης αυτής συνεπάγεται γνώση της διηλεκτρικής σταθεράς D και πρέπει ν' αναφέρουμε ότι υπάρχουν αμφιβολίες για το ποιά τιμή του D πρέπει να χρησιμοποιηθεί. Σε μελέτες πολυπεπτιδίων και πρωτεϊνών χρησιμοποιήθηκαν μ΄ επιτυχία τιμές του D από 2-5. Ένα πρόσθετο πρόβλημα είναι η εύρεση της κατανομής του φορτίου στο μόριο που εξετάζεται (για μικρά μόρια μπορεί να γίνει με κβαντομηχανικούς υπολογισμούς).
4. Ενέργεια υδρογονικών δεσμών
Υδρογονικός δεσμός δημιουργείται στην περίπτωση που ένα άτομο υδρογόνου βρίσκεται μεταξύ δύο ηλεκτραρνητικών ατόμων στη διάταξη C-H…X-D, όπου C και X ηλεκτραρνητικά άτομα.
Το μερικά θετικά φορτισμένο υδρογόνο (που είναι ομοιπολοκά ενωμένο με το C) έλκεται ηλεκτροστατικά από το X και έτσι παίζει ρόλο γέφυρας, δημιουργώντας ασθενή δεσμό μεταξύ τους. Πολλές μαθηματικές εκφράσεις έχουν προταθεί για να περιγράψουν την ενέργεια σχηματισμού υδρογονικών δεσμών (αναφ. 1,3,4). Μια απ΄ αυτές είναι η:
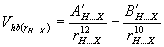 |
(7) |
όπου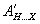 και
και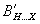 σταθερές για διαφορετικούς συνδυασμούς ατόμων συνδεδεμένων με υδρογονικούς δεσμούς (αναφ. 5).
σταθερές για διαφορετικούς συνδυασμούς ατόμων συνδεδεμένων με υδρογονικούς δεσμούς (αναφ. 5).
5. Ενέργεια πραμόρφωσης μήκους δεσμού
Στη διαδικασία προσαρμογής ενός μορίου από μια στερεοδιάταξη σε μια άλλη, είναι δυνατόν να μεταβάλλεται η γεωμετρία του. Συγκεκριμένα, μπορεί να αλλάξει το μήκος (1) ενός δεσμού και η γωνία (r) μεταξύ των δεσμών.
Η αύξηση στην ενέργεια που προκαλείται από παραμόρφωση Δ1 του μήκους ενός δεσμού, δίνεται από την σχέση:
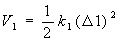 |
(8) |
Οι σταθερές Κ1 από μελέτες φασματοσκοπίας υπερερύθρου, βρέθηκε ότι έχουν τιμές 500-1200 kcal/mole/A2 για δεσμούς που απαντούν σε πολυπεπτιδικές αλυσίδες.
Δηλαδή μια αλλαγή 0.1 A στο μήκος ενός δεσμού, μπορεί να επιφέρει αύξηση της ενέργειας της τάξης των 5 kcal/mole.
6. Ενέργεια παραμόρφωσης γωνίας δεσμών
Η αύξηση στην ενέργεια που προκαλείται από παραμόρφωση κατά Δr μιας γωνίας μεταξύ ομοιοπολικών δεσμών, δίνεται από τη σχέση:
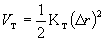 |
(9) |
όπου το Δr εκφράζεται σε ακτίνια (rad) και η σταθερή ΚΤ σε kcal/mole/rad2.
Η τιμή που χρησιμοποιείται συνήθως για την ΚΤ είναι 80 kcal/mole/rad2 για όλα τα είδη γωνιών (αναφ. 1).
Έτσι, μια μεταβολή γωνίας κατά 5o, επιφέρει αύξηση στην ενέργεια περίπου 0.3 kcal/mole, πράγμα που σημαίνει ότι θα πρέπει να περιμένουμε να υπάρχουν παραμορφώσεις αυτού του μεγέθους, στην περίπτωση που μια στερεοδιάταξη δεν είναι δυνατό να επιτευχθεί μ΄ άλλο τρόπο λόγω στερεοχημικών παρεμποδίσεων.
7. Δυναμικά περιστροφής
Έχουν σχέση με το σχετικό προνομιακό προσανατολισμό διαφορετικών ομάδων που βρίσκονται εκατέρωθεν ενός δεσμού.
Αρχικά θεωρήθηκε ότι υπάρχει ελευθερία περιστροφής γύρω από τους απλούς δεσμούς. Μελέτες όμως στο αιθάνιο έδειξαν ότι όλες οι καταστάσεις περιστροφής περί τον απλό C-C δεσμό του δεν είναι εξ ίσου πιθανές, και αυτό οδήγησε στην εισαγωγή των δυναμικών περιστροφής για να περιγραφεί μια τέτοια κατάσταση.
Η ύπαρξη των δυναμικών περιστροφής αμφισβητείται, και πολλοί θεωρούν ότι είναι ειδική περίπτωση απωστικών δυνάμεων Van der Waals. Η συνηθισμένη μορφή του δυναμικού περιστροφής γύρω από απλό δεσμό ατόμων με τετραεδρική στερεοχημεία είναι η:
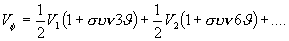
όπου V1, V2 .... είναι σταθερές σε (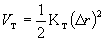 ) και
) και 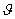 η γωνία περιστροφής.
η γωνία περιστροφής.
Οι όροι 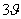 και
και 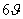 και οι σταθερές V1, V2 αναφέρονται σε τρίπτυχη ή εξάπτυχη συμμετρία. Για εξάπτυχη και μεγαλύτερη συμμετρία οι σταθερές έχουν πολύ μικρές τιμές και η εξίσωση διαμορφώνεται στην:
και οι σταθερές V1, V2 αναφέρονται σε τρίπτυχη ή εξάπτυχη συμμετρία. Για εξάπτυχη και μεγαλύτερη συμμετρία οι σταθερές έχουν πολύ μικρές τιμές και η εξίσωση διαμορφώνεται στην:
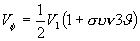 |
(10) |
Τιμές για τις σταθερές V1, V2 ... μπορούν να παρθούν από τις αναφορές 1, 3, 4.
8. Ενέργεια που περιγράφει την επίδραση του διαλύτη
Είναι φανερό ότι, ο όρος είναι ιδιαίτερα σημαντικός και μάλιστα στην περίπτωση που εξετάζουμε αλληλεπιδράσεις διαλύτη με σφαιρικές πρωτεΐνες, αφού οι πρωτεΐνες είναι σταθερές (ενεργειακά) στο H2O, για το οποίο διαφορετικές πλευρικές αλυσίδες εμφανίζουν διαφορετική "συγγένεια" (υδροφοβικότητα). Τα μόρια του H2O έχουν μεγάλη διπολική ροπή, είναι σε συνεχή θερμική κίνηση και τείνουν να ευνοήσουν ορισμένες διευθετήσεις γύρω από το μόριο (πολλές φορές λόγω σχηματισμού υδρογονικών δεσμών).
Γι΄ αυτούς τους λόγους, μια πλήρης αντιμετώπιση των αλληλεπιδράσεων H2O μορίου δεν είναι δυνατή στους περισσότερους υπολογισμούς. Μπορούμε όμως κατά προσέγγιση να θεωρήσουμε ότι η αλληλεπίδραση μιας συγκεκριμένης ομάδας του μορίου με το H2O είναι ανάλογη με την ποσότητα του H2O σ΄ επαφή με την ομάδα. (Για περισσότερες λεπτομέρειες ο αναγνώστης πρέπει ν΄ ανατρέξει στην αναφορά 3 και τις αναφορές που υπάρχουν εκεί).
ΙΙ. ΠΕΙΡΑΜΑΤΙΚΟ ΜΕΡΟΣ
Η άσκηση σχεδιάστηκε για να μελετηθούν οι σταθερές στερεοδιατάξεις (στερεοδιατάξεις ελάχιστης ενέργειας) ενός διπεπτιδίου και για την εφαρμογή των συμπερασμάτων που θα προκύψουν, στη μελέτη της στερεοδιάταξης των πρωτεϊνών αφ΄ ενός, και αφ΄ ετέρου, για να δείξει τη σπουδαιότητα των διαφόρων ενεργειακών παραγόντων στον καθορισμό της στερεοδιάταξης ενός μορίου (όπως αναφέρθηκε συνοπτικά προηγουμένως).
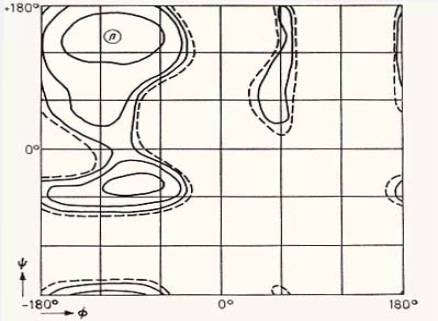
Για να μελετήσουμε τη στερεοδιάταξη ενός διπεπτιδίου πρέπει να υπολογίσουμε την στερεοδιαταξική ενέργεια για κάθε ζευγάρι φ, ψ (βλέπε Άσκηση 1) γωνιών. Στο στερεοδιαταξικό ενεργειακό χάρτη φ-ψ που θα προκύψει από τους υπολογισμούς, πρέπει να βρεθούν τα ελάχιστα ενέργειας και οι ενεργειακά σταθερές δομές που αντιστοιχούν σ΄ αυτά. Στην άσκηση γι΄ απλούστευση των υπολογισμών, και γι΄ άλλους λόγους (προβλήματα εκλογής σταθερών που προαναφέρθηκαν), μόνο οι όροι της ενέργειας για τις ελκτικές και απωστικές δυνάμεις Van der Walls θα ληφθούν υπ΄ όψη. Όμως, ο κύριος λόγος που δικαιολογεί μια τέτοια υπεραπλούστευση, είναι ότι οι όροι αυτοί (όπως έχει δειχτεί) συνεισφέρουν σημαντικά στην ολική ενέργεια μιας στερεοδιάταξης.
Ήδη αναφέρθηκε ότι, για τους όρους που αντιστοιχούν στις ελκτικές και απωστικές δυνάμεις, διάφοροι συγγραφείς προτείνουν διαφορετικά δυναμικά.
Σ΄ αυτή τη μελέτη χρησιμοποιείται ένα δυναμικό Lennard-Jones 6-12.
Συγκεκριμένα η ενέργεια μιας στερεοδιάταξης δίνεται από τη σχέση:
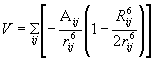 |
(11) |
όπου το άθροισμα 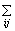 περιλαμβάνει όλα τα ζευγάρια i, j ατόμων που απέχουν τουλάχιστον 3 δεσμούς. Οι σταθερές Aij, Rij πάρθηκαν από την αναφορά 2.
περιλαμβάνει όλα τα ζευγάρια i, j ατόμων που απέχουν τουλάχιστον 3 δεσμούς. Οι σταθερές Aij, Rij πάρθηκαν από την αναφορά 2.
Οι υπολογισμοί της ενέργειας γίνονται με τη βοήθεια προγράμματος ηλεκτρονικού υπολογιστή γραμμένου σε γλώσσα FORTRAN, σύμφωνα με το υπόδειγμα που δίνεται στο παράρτημα.
Συνοπτικά, οι κύριοι υπολογισμοί που εκτελούνται με το πρόγραμμα είναι:
1. Οι συντεταγμένες y, x, z των ατόμων ενός μορίου, γνωστής γεωμετρίας, διαβάζονται κατά ορισμένο τρόπο και σε κάθε άτομο δίνεται ένας κωδικός αριθμός (ο ατομικός του αριθμός), για να γίνεται διάκριση των διαφορετικών αλληλεπιδράσεων.
2. Οι συντεταγμένες μετασχηματίζονται σε A (σε ορθογώνιο σύστημα αξόνων αν δεν έχουν δοθεί σε A), και με διάφορες περιστροφές, κατά διαφορετικές γωνίες, γύρω από προκαθορισμένους δεσμούς, το μόριο που εξετάζεται αποκτάει μια "αρχική" στερεοδιάταξη.
3. Εξετάζεται ποιών ατόμων οι αποστάσεις μεταβάλλονται κατά τις περιστροφές που ακολουθούν, ώστε οι αλληλεπιδράσεις μεταξύ τους να ληφθούν υπ΄ όψη στους ενεργειακούς υπολογισμούς.
4. Η δυναμική ενέργεια υπολογίζεται σαν συνάρτηση δύο γωνιών στροφής φ, ψ που μεταβάλλονται σ΄ ορισμένα όρια, κατά ορισμένα "βήματα", χρησιμοποιώντας τη σχέση (11).
5. Αποτέλεσμα του προγράμματος είναι ένας στερεοδιαταξικός ενεργειακός χάρτης φ-ψ, η μελέτη του οποίου θα γίνει με τη βοήθεια του υπευθύνου.
Σημείωση: Το πρόγραμμα επιτρέπει τον υπολογισμό της ενέργεια και γι΄ άλλα είδη αλληλεπιδράσεων πλην των ελκτικών και απωστικών δυνάμεων (Van der Waals).
Οι ερωτήσεις στις οποίες θ΄ απαντήσετε γραπτά μετά τη μελέτη του ενεργειακού χάρτη είναι:
1. Ποιά σύγκριση μπορεί να γίνει μεταξύ του στερεοδιαταξικού χάρτη ενέργειας που παίρνεται και του Ramachandran plot της άσκησης 1. Εξηγήστε.
2. Ποιές είναι οι στερεοδιατάξεις ελάχιστης ενέργειας που διαπιστώθηκαν; Έχουν παρατηρηθεί πειραματικά;
3. Πώς επεκτείνεται η ανάλυση σε πολυπεπτιδικές αλυσίδες;
4. Διαπιστώνετε τη σημασία των δυνάμεων Van der Waals από το χάρτη που πήρατε, και αν ναι γιατί;
ΠΑΡΑΡΤΗΜΑ
Εκτέλεση του προγράμματος
Για την εκτέλεση του προγράμματος που υπολογίζει την στερεοδιαταξική ενέργεια πρέπει να δοθούν τα ακόλουθα δεδομένα:
13 (Αριθμός ατόμων διπεπτιδίου)
23 (Κωδικός)
0. 0. 0. 6 Συντεταγμένες (x, y, z) των
1.51 0. 0. 6 ατόμων του διπεπτιδίου και
2.1393 -1.0684 0. 8 ο κωδικός κάθε ατόμου
2.0909 1.1909 0. 7 (ο ατομικός του αριθμός)
1.5504 2.0559 0. 1
3.5379 1.3429 0. 6
4.1331 0.6459 -1.2388 6
3.9589 0.8499 0.8765 1
3.9287 2.8014 0. 6
3.0442 3.6705 0. 8
5.2293 3.0542 0. 7
5.9249 2.3082 0. 1
5.7508 4.4126 0. 6
1.0 1.0 1.0 90.0 90.0 90.0 (κωδικοί)
4 6 9
|
(Αριθμοί ατόμων που καθορίζουν γύρω από ποιούς δεσμούς γίνεται περιστροφή. Στη συγκεκριμένη περίπτωση γίνεται περιστροφή γύρω, από τους δεσμούς 4-6, 6-9)
0. 0 350 10
0. 0 350 10 κωδικοί
1
|
ΑΝΑΦΟΡΕΣ
1. Ramachandran, G.N. and Sasisekharan, V. (1968) Adv. In Prot. Chem., 23, 284
2. Scott, R.A. and Scheraga, H.A. (1966) J.Chem. Phys., 45, 2091
3. Levitt, M. (1976) J. Mol. Biol., 104, 59
4. Momany, F.A., McGuire, R.F., Burgess, A.W. and Scheraga, H.A. (1975) J. Phys. Chem., 79, No 22, 2361
5. Momany, F.A., Carruthers, L.M., McGuire, P.F., and Scheraga, H.A. (1974) J. Phys. Chem., 78, 1595

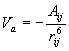
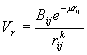
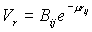 και ο τύπος Lennard-Jones
και ο τύπος Lennard-Jones 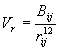 (4)
(4)
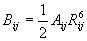
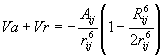
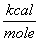 αν το r τεθεί σε A.
αν το r τεθεί σε A.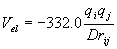
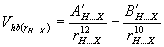
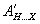 και
και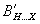 σταθερές για διαφορετικούς συνδυασμούς ατόμων συνδεδεμένων με υδρογονικούς δεσμούς (αναφ. 5).
σταθερές για διαφορετικούς συνδυασμούς ατόμων συνδεδεμένων με υδρογονικούς δεσμούς (αναφ. 5).
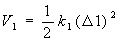
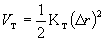
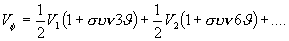
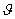 η γωνία περιστροφής.
η γωνία περιστροφής.
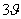 και
και 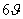 και οι σταθερές V1, V2 αναφέρονται σε τρίπτυχη ή εξάπτυχη συμμετρία. Για εξάπτυχη και μεγαλύτερη συμμετρία οι σταθερές έχουν πολύ μικρές τιμές και η εξίσωση διαμορφώνεται στην:
και οι σταθερές V1, V2 αναφέρονται σε τρίπτυχη ή εξάπτυχη συμμετρία. Για εξάπτυχη και μεγαλύτερη συμμετρία οι σταθερές έχουν πολύ μικρές τιμές και η εξίσωση διαμορφώνεται στην:
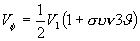
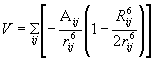
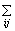 περιλαμβάνει όλα τα ζευγάρια i, j ατόμων που απέχουν τουλάχιστον 3 δεσμούς. Οι σταθερές Aij, Rij πάρθηκαν από την αναφορά 2.
περιλαμβάνει όλα τα ζευγάρια i, j ατόμων που απέχουν τουλάχιστον 3 δεσμούς. Οι σταθερές Aij, Rij πάρθηκαν από την αναφορά 2.